�I�Χ��B���ؤ� 1999 ��ʺؤl��TTC�ˬd�k�C�Ӫ��ح] 1: 47-56�C
Shie, C.H. and W.H.J. Kuo 1999 Tetrazoloium Test for
the Seed of Carica papaya L. Seed and Nursery (Taiwan) 1: 47-56.
�@
Tetrazoloium Test for
the Seed of Carica papaya L.
Chia Hong Shie1�^ and Warren H.J. Kuo2�^
Department of Agronomy, National Taiwan University,
Taipei 107, Taiwan.
1�^Present address: Taiwan Tea Experiment Station,
Taoyaun, Taiwan.
2�^Corresponding author.
�@
SUMMARY
Non-dormant papaya seeds subjected to different
accelerated-aging levels are used to evaluate the pattern of the TTC-stained embryo. The
procedure of TTC testing for papaya seeds is proposed as follow: Soak the seeds in water
over night, then remove the testa and endosperm. Stain the de-coated embryo by 0.5% TTC
solution at 37.5�J for 3 hours. Twelve categories are sorted out from the patterns of TTC
staining. (fig 1) Halve of the embryo of a seed lot
which containing only 2.5% viable seeds stained red, which deviate from viable one only by
a slightly tint of opaque. (fig 2) The viability
status of each category is determined by the calculation of minimum root mean square
method. (table 1) The criteria for the evaluation of staining
pattern thus determined predict the germination percentage of papaya seeds of different
sources and cultivars accurately. (table 2) In order to
harmonize with the ISTA rules, it is suggested that, the maximum area of unsuccessful
staining for a viable papaya seed to be 1/3 radicle, with a remark that the red colour
with an opaque or glassy appearance should be considered as dead.
Key Words: Carica papaya L., seed, TTC,
TZ test
�@
�� �� �� �l �� TTC �� �d �k
�I�Χ�1�^�B���ؤ�2�^
�x�_�� ��ߥx�W�j�� �A���Ǩt
1�^�{�����H�߯��~��}���U�z
2�^�q�T�@��
�@
�Τ��P�[�t�ѤƵ{�ת���ʺؤl��wTTC�V��G����P�C����{�ǫ�ij�p�U�G�ؤl�g25�J�����j�]��A�h����Ӻإ֤έF�šC�r�F�H0.5�MTTC���G��37.5�J�V��3�p�ɡF�F�gTTC�V���i������12�جV�⫬���C���v�̧C�]2.5%�^���˫~�X�G���@�b���ؤl�i�H�V������A���L�ӵ����Ⲥ�㯻�����z���P�C�H�̤p�ڧ���k�D�X�V�⫬������P�ǫh�C�g�Ѯڧ���k�ҽT�ߪ��V������ǫh���T�a�w�����P�ӷ��Τ��P�~�ت���ʺؤl���o�v�C�����i��ij�A�̷�ISTA�ؤl�ˬd�W�h���榡�A��ʺؤlTTC���窺��P�ǫh�O�G�i�e�\���V�⥢�ѳ̤j�d�F�ڮڦy1/3�A�ҬV������Y�a�������z���P�Τ������P�A�h�����ؤl�C
������G��ʡB�ؤl�B
TTC�BTZ�k
�@
�@
�@
�@
�e ��
��ʡ]Carica
papaya L.�^���ڰ꭫�n�g�٪G�𤧤@�A�q�`�H�ؤl�c�ޡA�]�������ؤl���~�誺�n�D�ƹd�C�ؤl�~�誺���w�H�o�v�����w���D�C�M�ӡA�ѩ��ʺؤl�`���v�ʡA�o���窺���G�i��C���ؤl���s���v�F���~�A��ʺؤl���o����`�ݭn�T�g�H�W�A�b�ݭn�ֳt�o���ˬd���G�ɡA�L�k�@�����Ī������k�C
�Q��TTC��TZ�k�]Tetrazolium test�^����ؤl�o�ޯ�O�w�s�x���Ω�h�شӪ��C����TTC�k�b�w���ؤl�s���v�P��ڵo�v�����T����������ʦs�b�A�B�w���M���Ω�\�h�A���A�����ΪL��ؤl�]ISTA,
1993�^�C���k����z�O���ӭM����B�@���ʯ�N�L�⪺��ƥ|���]tetrazolium
chloride�^�٭즨�������������I�����ƦX��formazan�Aformazan���ຯ�X�ӭM�~�A�]�����`�ӭM���h���������L��C�̾ڭF�έF�ŬV�⪺���G������C��`�L�A�Y�i�P�w�ؤl���s���v�]���A1983�FMoore, 1985�^�A�Ӥ�����v������C
�ؤl��TTC����k�w�����Y�z�ؤl���Ҧ��ˬd���ءA�ΨӨ��N�@�몺�o����]���A1990�^�A�Y�K�b�ڰ�A�]���N���ԲӪ��ޤ��]�p�G���A1964�F���A1983�^�F�M�ӡA����k�b�ڰ�ؤl�Ǭ�s�������h���A�ؤl�ˬd��쨴���]�|���įǬ��ˬd�����ءC
�U�غؤlTTC�k���ާ@�B�J�A�]���P�Ӫ��Ӳ��A�V��ᦺ�����P�w�ǫh��U���Ҥ��P�]ISTA,
1993�^�C�ѩ��ʺؤl�|�L������ƥi�`�A�]������s���w��V�⪺�{�ǤΧP�O�ǫh�[�H���Q�A�H�����X��ʺؤl��TTC����k�C
�@
���ƻP��k
�H���x�A�G������ʳ��ؤl��������ơA�N�t���v12%���ؤl�K�ʫ�b47.5�J�U�B�z0-10�ѡA�H�o��C�Ť��P�ѤƵ{�ؤl�A���O�i��o�v����PTTC�V��C
�ؤl�o�v�����w�O���N�ؤl����500 ppm��GA3���G�@�ѫ�A�ĥα��Ȫk�A�m��30/25
�J�]8/16 h�^�ܷŷӥ����ͪ��c�i��o����]�I�P���A1996�^�C�C�B�z����4���A�C����50�ɺؤl�C�H�U�F�b���F1.5 cm�H�W�A�l���ۺإֲ�X�A�i�P�w�����`�]�ɵ����o�ޡC�m�ɴ�����30�ѡA������p��o�ަʤ��v�C
���ؤl�˫~4���ơA�C����50�ɡA�i��TTC���窺��s�C�V���k�Ѧ�ISTA�] 1993 �^���ˬd�{�ǡA�øg���P�V��ūסBTTC�@�ץH�ή����ɶ����w�Ƹ��窺���G�A�N��ʺؤlTTC����{�ǭq���G
1.�ؤl����6-18�p�ɡ]25�J�·t���^�C
2.�H���l���h�l�h���~�إ֤Τ��إ֡C
3.�H�h�l�Υ٪��D�w�N�F�q�F�Ť����X�A�ާ@�L�{���קK�ˤέF�C
4.�r�F��J�ٶq�~���A�ˤJ0.5%��TTC���G��37.5�J�·t�U����3�p�ɡC
5.���~�F���ѭ���L��U�[��P�_�C
���N�C�ӭF���V��G�̤l���P�F�ڪ��V�ⱡ�γv�ɵn�O���h�ӫ��A�A�O���C�ӫ������ɼơC�����˫~�ҬV�⤧��A�Ѧ�
Moore�]1985�^��ISTA�]1993�^�������P�_��h�A�N�����V��G�k�Ǧ�12�����C�z�פW�C�����i��N�����Ϊ̬��ؤl�A�]���P�_�ǫh����212�ӥi��զX�C�o�Ƿǫh�O�_�i�a�A�h�O��RMS�]root mean square�^�k�ӨM�w�]Kuo
et al., 1995�^�FRMS���p��p�U�G
�@RMS= [(G1-P1)2
+ (G2-P2)2 +......+ (Gi-Pi)2
+...... +(Gn-Pn)2 )/n]0.5
�@
�䤤Gi����i�]�]��^�ؤl�u���o�v�FPi����i�]�]��^�ؤl�gTTC�����A�b�Y�P�_�ǫh�U���w���o�v�Fn�������˫~�]�]��^�ơC����U�اP�_�ǫh��RMS�A�H��o�̤pRMS���P�_�ǫh�@�����T���P�_�̾ڡC
�t������ؤ@��B���鰥�����B���x�A�@�����@��B���x�A�G�������A
���x�A�G�����G��ұĪ��ؤl�T��A�H�����x�A�������G��ұĪ��ؤl�@��A���O�i��o����PTTC���絲�G������A�H�˩w�g�e�z�{�ǩҭq�ߪ�TTC�V���P�ǫh�C
�@
���G�P�Q��
TTC�k���n�I�O�A�ؤl����e�B�z�A�ϭF���o�H�PTTC���G�R����IJ�C�w�Ƹ�����ܡA�U�ظ���²�����ާ@�覡�A�]�A�ŴߡB���]Knierim
and Leist, 1988�^���A�ҵL�k���Ħa�N��ʭF�V��A�]���ݱN�r�F���X�î���TTC���G�C���k�������c���A���L��L��ܡC���P�ѤƵ{�ת���ʺؤl�gTTC�V�����ܡA�F�V�⪺���A�h�Ҥ��P�F�̬V�ⳡ��Φ�A����12�جV�⫬���]��1�^�A�䤤��1���̥��F�V��e�����A����C��2���̥��F�V��e�����A����A���F�ڬ�1/2�B�ܭF�ڰ��e�H����C��3���̭F�ڤΦܤl����´��1/2�B�V��e�����A����A��l�l����´�h�C����H�C�b�o�T�ӫ������A�����ڦy���ݳB�V��ܲL�Τ��V��A�ھ�ISTA����P�ǫh�A�����v�T�P�_�A�]�����t�k���C
��
4���̤l���V���A����A���F�ګe�ݬ�1/3��1/2�B���V��ά��L����A��l�F�ڲ�´�V�⥿�`�A�e�����A����C��5���̭F�ڬV���A����A���l����´�e�L����a�z�����C��6���̤l���V�������A����A���X�G��ӭF�ڥ��V��άV���H����C
��
7���̥��F�V�⥿�`�A�P��1�����V��G�۪�A�����⤧��A���L�A���ǭF��´�e���ä��z��������P�C��8���̤l���V��G�P��7���ۦP�A���F�ڬ���1/3����Ʀܾ�ӭF�ڧe�V��ܲL�Τ��V��C��9���̤l���X�G���V��Τl���e�զ���a���p���߯뤧����������F�F�ڬV�⥿�`�Χ������V��A�άV�����L�C
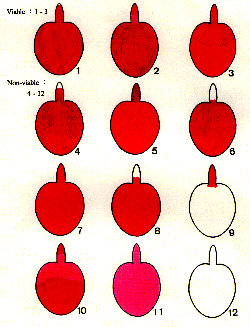
|
1.whole
embryo stained red.
2. basal part of the radicle stained light red, the rest part
red.
3. distal half of the cotyledons stained light red, the rest
part red. Those less than 1/3
radicle tip unstained are not excluded from the above 3 patterns.
4. more than 1/3 radicle tip unstained.
5. cotyledons stained glassy red.
6. radicle unstained.
7. whole embryo stained red, with a tint of opaque.
8. more than 1/3 radicle tip unstained, the rest part glassy
red.
9. cotyledons unstained.
10. basal part of both radicle and cotyledons stained light
red.
11. whole embryo stained light red.
12. whole embryo unstained. |
�� 1�A��ʭF��12��TTC�V�⫬���C�䤤��1�A2�A3�������ؤl�A�ԥ���C
Fig. 1, Twelves TTC-staining patterns of
the embryo of Carica papaya L. Only pattern 1, 2 and 3 are considered viable.
�@
��10���̭F�ګe�ݬ�1/2�B�Τl�����ݬ�1/2��1/3�B�V���A����A��l��´�h�V��ܲL�Τ��V��C��11���̥��F�ҧ��ìV��A����A�e���L���H����A���Ǥl����´�����L���H����B���a�z�����C��12���̥��F�����L�V��A��´�e�զ�A���ǭF�کέF�ڤ������e�ǷL�B��A���L���H����C�U�ŦѤƵ{�ؤl���V��������@�A���i���V������1�P2���ƥ��H�ۺؤl�H�ܵ{�ת��[�`�Ӵ�֡C���S���̬O�o�v��2.5%���˫~�A�V�⪺���G�X��@�b���F�i�H�����V�����Ⲥ�a���z���P
������A�P��1��������Ȧ��L�p���t���A���ݩ�7�]��1�^�C��ʺؤl�gTTC����ᤧ12�جV�⫬���P�_�ǫh�A����ںؤl�ˬd�W�h�W�ҦC���p���B�j���B�³��οP�����������������h�A���PPasha�MDas �]1982�^���j��10��TTC�V��G�۱���C�ѩ�V�⫬�������Ӧh�A�ӥB�]�A������P�p��5��7���̡A�ϱo�p��N���k�������ά����ؤl�x���C�Ω��ʻP�@����]Salvia
splendens Sell ex Roem.�^�ؤl��RMS�k�]Kuo et al., 1995�^�A�h�i�H���[�a�J�A���x���C
�@
�� 1�A���P�ѤƵ{�פ�ʺؤl�gTTC�����F������U�V�⫬�����ƥ�
Table 1,
Distribution of embryos to each stain pattern after TTC tests of the papaya seeds 1�^
of different aging level
Stain pattern |
Aging days under 47.5�J and 12% seed moisture
content |
sum |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
1 |
142 |
157 |
113 |
143 |
95 |
61 |
0 |
711 |
2 |
23 |
9 |
32 |
4 |
1 |
1 |
0 |
70 |
3 |
4 |
1 |
1 |
0 |
2 |
0 |
0 |
8 |
4 |
2 |
7 |
7 |
12 |
44 |
47 |
0 |
119 |
5 |
2 |
1 |
22 |
8 |
7 |
13 |
0 |
53 |
6 |
2 |
3 |
0 |
5 |
9 |
14 |
0 |
33 |
7 |
10 |
1 |
6 |
7 |
11 |
16 |
96 |
147 |
8 |
4 |
3 |
1 |
2 |
3 |
17 |
4 |
34 |
9 |
6 |
9 |
9 |
12 |
22 |
17 |
40 |
115 |
10 |
2 |
3 |
1 |
1 |
0 |
1 |
4 |
12 |
11 |
0 |
0 |
0 |
2 |
0 |
1 |
16 |
19 |
12 |
3 |
6 |
8 |
4 |
6 |
12 |
40 |
79 |
sum |
200 |
200 |
200 |
200 |
200 |
200 |
200 |
1400 |
| Germination 2�^ |
84 |
85 |
72 |
68.5 |
49 |
27 |
2.5 |
�@ |
1�^ Cultivar��Tainung no. 2��
2�^
%
Normal germination, + GA3
�@
�̷�TTC�k��z�����V���P�ǫh�A��4�B6�B8�B9�B10�B11�B12�����̬����ؤl���L�ü{�A�M�Ө�L�����h�����P�_�C�]���ڧ���]RMS�^���p��u�ݭn�w���1�B2�B3�B5�B7�����A�]�N�O25�ӲզX�C�p��G��ܡA�Y�N��7�̵������ؤl�A�ұo�쪺RMS�Ұ��L10�A���ܦ��V�⫬���N�����ؤl�]���C�J��2�^�C�Ѫ�2�ҦC������RMS�p��G�i���A�H��1�B2�B3������P�����ؤl�A��l�����ؤl�̨ΡC�bTTC�V��G�p��P�O�W�ARMS�k�i�H���Ѹ������[������]Kuo
et al., 1995�^�C�M�Ӧ��حp���k�Y�Φb�㦳��v�ʪ��ؤl�ɡA�i��y����P�ǫh�����~�C�]���Y�ؤl�㦳��v�ʡA�ӥB�L�k�ΤH�����B�z�����P�i�ؤl�o�ޮɡA�h�e�z����ڵo�ަʤ��v���M�C���˫~���u�����v�A�]�өҰ����έp���R�N���ͻ~�t�C�ѩ��ʺؤl�i���`�ץ�v�]�I�A1995�^�A������ĥεL��v�ؤl�Ӷi��[�t�ѤƳB�z�A�ұo���C�o�v�ؤl�A�T�w�ëD��v�Ҥް_�C�]����5��7�������V��A���M���F�ү�V�����a�z�����ί���������A�z�LRMS���p��A�����P�����ؤl�C
�@
�@
�� 2�A��ʭFTTC�V�⫬���������ؤl�ҹw�����s���v�P��ڵo�ަʤ��v�����t���������
Table 2, Root mean square determination 1�^
for the representation of some TTC staining pattern
Patterns considered as viable 2�^ |
Root Mean
Square |
1,2,3
|
2.69
|
1,2
|
2.8
|
1,3,5
|
6.66
|
1,2,5
|
6.95
|
1,2,3,5
|
7.14
|
1,5
|
7.17
|
1,3
|
7.46
|
1
|
8.29
|
1�^RMS of the
difference between germination percentage and TTC-predicted viability percentage,
calculated from the data of table 1.
2�^
Those pattern combinations that
yield RMS larger than 9.0 were omitted.
�@
�@
�t���w���������ؤl�ӬV��A���T�o����F�ҥi�V���̦p��2�ҥܡA�O�ݩ���5��7���CGanguli
et al.�]��Gitali and Sen-Mandi, 1992�^�o�{�Ѥƪ��p���F�]��V������A�Y���Ӥ@�몺�P�_�ǫh�A�������ؤl�A�|�ɭP�~�P�C�ѩ��ʺؤl�g�L�H�u�ѤƳB�z�A�o�Ǧ��ؤl����V������A�t�ܭF�����ï����㬡�ʡC��RMS���p��A���w�V�⫬��5��7�̬����ؤl�A�P��2�g�[�t�Ѥƪ����ؤl�ӬV�⪺���G�۲šC�M�ӳo�ä����ܥ��g�[�t�Ѥƪ��˫~�N�S���o�ػ~�P�����|�C�b�����礤�A���g�ѤƳB�z�̡]��1���Ѥ�0�ѡ^�A���������ؤl���V��e�{����5��7�A�]���b�i���ʺؤl�Ҧ檺TTC����ɡA���ݭn�`�N�V�����z���P���������̡A�βL����a�z�����̡A�N���P�����ؤl�C
 |
�� 2�A��ʬ��]�W�^�P�[�t�ѤƦӦ����]�U�^�ؤl�gTTC�����F���V��C
Fig. 2, The result of TTC test of viable (upper) and dead (lower) seeds of Carica papaya
L. The dead seeds were obtained by accelerated aging. |
�@
�@
�ҽT�w��TTC�V��P�w�ǫh�A�Ψӹw���t10��ؤl�����v�ɡA�|�������[GA3�B�z���o�v�]��3�^�A���]���O�Ѹպؤl����v�ʩҭP�CMoore�]1962�^����X�A�Q��TTC�k���w�Y�ǪL�����ؤl�ɡA�Y�w�����O�ȸ�����o�v���̡A�Y�i��]�ؤl���v�ʩҭP�C�Y�b�o�ޫe�w��GA3�A�hTTC�k���w���۷��ǽT�]��3�^�C�ѩ�Y�ǥ�v�ʰ�����ʺؤl�A�Y�ϥ[GA3�B�z�A�o�v�������]�I�A1995�^�A�]������Ҵ��X��TTC�k���i�H�קK��ʺؤl�o�����]�ؤl��v�ʩҳy�����~�P�C
�@
��
3�A�Q���ʺؤl���o�v�PTTC�ҹw�����s���v
Table 3,
Germination percentage and TTC-predicted viability of 10 papaya seed accessions
Viability, % �]TTC test�^ |
Normal germination, % |
| +
GA3 |
��GA3 |
| 99.5±1.0 |
94.5±4.7 |
44.0±7.3
|
| 99.3±1.2 |
99.5±1.0 |
93.5±3.4
|
| 98.5±3.0 |
98.0±1.6 |
62.5±14.2 |
| 96.0±2.0 |
89.0±3.5 |
84.0±5.9
|
| 92.5±1.9 |
88.0±5.9 |
74.5±9.2
|
| 76.7±3.1 |
75.5±2.5 |
52.5±6.0
|
| 72.5±5.0 |
66.0±6.7 |
34.0±7.1
|
| 65.0±18.0 |
61.0±5.3 |
51.0±7.4
|
| 16.0±17.5 |
16.0±9.4 |
17.0±4.8
|
| 10.5±5.0 |
12.5±5.5 |
14.0±2.8
|
Mean 72.7 |
70 |
52.7 |
�@
���F²�ƬV�⪺��P�ǫh�A�A�Բ��[���1�A���G�i�H�N��ʺؤlTTC����k����P�ǫh�̷�ISTA�W�h�]1993,
��6A�^���榡�A�b�u��P�]�i�e�\���̤j�L�V��B�n�z�B���a�j���̤j�d��^�v�椤�����G�F�ڮڦy1/3�F�Ӧb�u�Ƶ��v���h�����G�ҬV�����C��Y�a�������z���P�A�h�����ؤl�C
�ѩ��ʺؤlTTC�˩w�{�Ǥ��A���F���ާ@�L�{���@��ؤl���c���B�O�ɬƤ[�A�ר�ݨ���m���F�N���H���ާ@���A�_�h�������ѡC�S�O�O�������ؤl���F���i�H�����V��A�惡���ؤl�A�ݭn�J�Ӥ���F�ҬV��A�A�O���k�����I�C�p��J�A���@�~�V�A���i�@�B�ﵽ��ʺؤlTTC�ˬd�k�����V�O����V�C
�ѩ�TTC�k���ǽT�ʦ��������̪��g��A�]���A�bTTC�k�|���Q���T�ߪ��ڰ�A����̩ҭ��{���̤j���D�A�S�O�O�w��S���g�L��s�����ءA�N�O�V��G���P�_�O�_���T�C�b�L�㦳�g��̪����ɤU�A�i�H�Q�Υ���s�ұĨ���RMS�k�Ӷi��ۧڽm�ߡC���h�夣���v�ʡA���ؤl�o�v���C���P���˫~�Ӷi��V��C�N�F�V��G�������Y�z�����A�M��N�V�⪺�w���ؤl���v�P��ڪ��o�ަʤ��v�i��έp������A�i�H���[�a���٦U�V�⫬���A�S�O�O�����P�_���V�⫬���A�ҥN�����ؤl���A�C
�@
�x ��
������b�A�e�|�p�e�]85���-1,4-³-05�^�g�O��U�U�i��A�S�ӻ�s���a��������Ҥ��w�k�D���B�L���F���͡A�ح]��}�c���x�w�Ҫ��A�x�F�ϹA��������ե��͡A�H�Ϋ̪F���M�A���ڪF�Y�g�z�B�x�n�ɤ��m���ө����͵���U���Ѻؤl�A�L���ؤp�j���ѹ�2�A�b���@�֭P�¡C
�@
�ѦҤ��m
������1964 �ؤl�ͬ��O���t���k�C�A�_�|�A�x�_�C
�����^
1983 �ؤl���O���ͤ��˩w�]�W�B�U�^�C����A22�]1�^: 4-16�B22�]2�^: 14-22�C
�I�Χ�
1995 ��ʺؤl��v�J�äά��O���w�k�����Q�C�x�W�j�ǹA���Ǭ�s�ҺӤh�פ�A�x�_�C
�I�Χ��B���ؤ�
1996 ��ʺؤl���q�ɫ״���C�x�j�A�|����A36:
247-258�C
���ؤ�
1990 ��w
Baden-Wurtemberg �ؤl�ˬd��²���C��ǹA�~ 38:
44-47�C
Gitali, D. and Sen-Mandi, S. 1992 Triphenyl tetrazolium chloride
staining pattern of differentially aged wheat seed embryos. Seed Sci. Technol. 20,
367-373.
ISTA 1993 International Rules for Seed Testing. Rules, 1993. Seed
Sci. Technol. 21, Supplement.
Knierim, M. and Leist, N. 1988 Verbesserung der Untersuchungsmethode
auf Lebensfahigkeit nach dem Tetrazolium-Verfahren bei Abies-Saagut (Abies spp.). Seed
Sci. Technol. 16:227-237.
Kuo, W.H.J., Yan, A.C. and Leist, N. 1995 Tetrazolium test for the
seeds of Salvia splendens Sell ex Roem. & Schult and S. farinacea Benth.
Seed Sci. Technol. 24:17-21.
Moore, R.P. 1962 Tetrazolium as a universally acceptable quality test
of viable seed. Proc. Intern. Seed Test. Asso. 27:795-805.
Moore, R.P. (ed.) 1985 Handbook on Tetrazolium Testing. The
International Seed Testing Association, Zurich.
Pasha, M.K. and Das, R.K. 1982 Quick viability test of soybean seeds by
using tetrazolium chloride. Seed Sci. Technol. 10:651-655.
�@
����
received�G1998-08-07�F���� accepted�G1998-09-08